Kiến thức
Tiềm năng của Dầu Mù U trong điều trị viêm da cơ địa
Dầu Mù U hay còn gọi là Dầu Tamanu, chiết xuất từ hạt của cây Calophyllum inophyllum L., đã được sử dụng truyền thống để điều trị các bệnh liên quan đến da. Trong những năm gần đây, loại dầu này ngày càng trở nên phổ biến khi các nhà nghiên cứu tiếp tục tìm kiếm các phương pháp trị liệu tự nhiên mới cho các bệnh về da. Đã có một số nghiên cứu in vitro và in vivo điều tra các tính chất hoạt động trên da của Dầu Mù U, và nó đã được chứng minh là có khả năng chống viêm, chống oxy hóa, kháng khuẩn, giảm đau và thậm chí cả khả năng làm lành vết thương mạnh mẽ. Những đặc tính này làm cho Dầu Mù U trở thành một ứng cử viên đặc biệt thú vị cho việc điều trị viêm da cơ địa (AD). Bệnh đa phức tạp này được đánh dấu bởi sự phá vỡ chức năng hàng rào da, viêm nhiễm mãn tính và mất cân bằng vi khuẩn da với các phương pháp điều trị hạn chế, không gây tác dụng phụ và tiết kiệm chi phí, khiến người ta cần một lựa chọn điều trị mới. Trong bài tổng quan này, chúng tôi xem xét các nghiên cứu in vitro và in vivo trước đây về các tính chất dược lý có liên quan đến AD của Dầu Mù U để đánh giá tiềm năng của Dầu Mù U như một lựa chọn điều trị mới cho AD.
*Ghi chú: Atopic Dermatitis (viết tắt là AD) có nghĩa là Viêm da cơ địa.
1. Giới thiệu
Các sản phẩm tự nhiên từ lâu đã được khám phá như một nguồn tiềm năng cho các phương pháp điều trị mới, và Dầu Mù U cũng không ngoại lệ. Các bộ phận khác nhau của cây này đã được phát hiện có tiềm năng chống lại nhiều bệnh khác nhau, đặc biệt là các bệnh liên quan đến da như chàm, vẩy nến, bỏng, mụn trứng cá, bệnh da và thậm chí là điều trị vết thương. Trong bài báo này, chúng tôi sẽ tổng quan các tính chất dược lý của Dầu Mù U và các chiết xuất từ hạt mù u, cụ thể là khả năng chống viêm, kháng khuẩn, làm lành vết thương và chống oxy hóa của nó. Tất cả các hoạt động này được kỳ vọng sẽ có ích trong việc giảm nhẹ các triệu chứng thường gặp ở bệnh nhân viêm da cơ địa. Viêm da cơ địa (AD) là một trong những bệnh viêm da mãn tính phổ biến nhất của thế giới công nghiệp và có gánh nặng bệnh lý cao nhất trong số các bệnh về da trên toàn cầu. Tỷ lệ mắc AD tiếp tục tăng trên toàn thế giới, và các tài liệu cho thấy sự gia tăng của AD ở các nước đang phát triển bắt đầu tương đương với các nước phát triển. Mặc dù bệnh này ảnh hưởng đến tới 2.4% dân số thế giới, bất chấp sự gia tăng tỷ lệ mắc và gánh nặng mà nó đặt ra cho hệ thống y tế công cộng toàn cầu, hiểu biết của chúng ta về AD và các phương pháp điều trị hiện có cho AD vẫn còn hạn chế. AD là một bệnh cực kỳ đa dạng với nguyên nhân phức tạp do sự kết hợp của các yếu tố miễn dịch, môi trường và di truyền, dẫn đến sự điều chỉnh và rối loạn của phản ứng miễn dịch. Do sự đa dạng của bệnh, đến nay AD vẫn chưa thể chữa khỏi, và các phương pháp điều trị hiện tại chỉ giới hạn ở việc giảm nhẹ triệu chứng và phòng ngừa sự trầm trọng của AD. Việc điều trị ngoài da bằng corticosteroid là trụ cột trong điều trị các trường hợp từ trung bình đến nặng. Chúng được sử dụng để giảm các đợt bùng phát và duy trì bệnh. Vấn đề với phương pháp điều trị này là việc sử dụng corticosteroid có thể gây ra nhiều tác dụng phụ cả về da và toàn thân, như mỏng da, rạn da và thậm chí là giãn mao mạch. Các phương pháp điều trị khác như sử dụng các ức chế calcineurin, liệu pháp ánh sáng hoặc điều trị toàn thân đều tốn kém hoặc đi kèm với tác dụng phụ không mong muốn. Do đó, có nhu cầu cấp thiết trong việc phát triển các phương pháp điều trị mới không chứa steroid, tự nhiên không chỉ rẻ tiền mà còn tăng cường hiệu quả và an toàn. Các tính chất dược lý đa dạng của Dầu Mù U đã được chứng minh trong các nghiên cứu trước đây làm cho Dầu Mù U trở thành một phương pháp điều trị tự nhiên hứa hẹn để điều trị và cải thiện triệu chứng AD. Tuy nhiên, chưa có nghiên cứu in vitro hoặc in vivo nào đánh giá trực tiếp việc sử dụng Dầu Mù U cho điều trị AD. Vì vậy, mục đích của bài tổng quan này là để suy luận thông tin hiện tại dựa trên các nghiên cứu mới nhất sử dụng Dầu Mù U. Ngoài ra, bài tổng quan này cũng sẽ thảo luận về các hướng nghiên cứu tương lai có thể có trong lĩnh vực này.
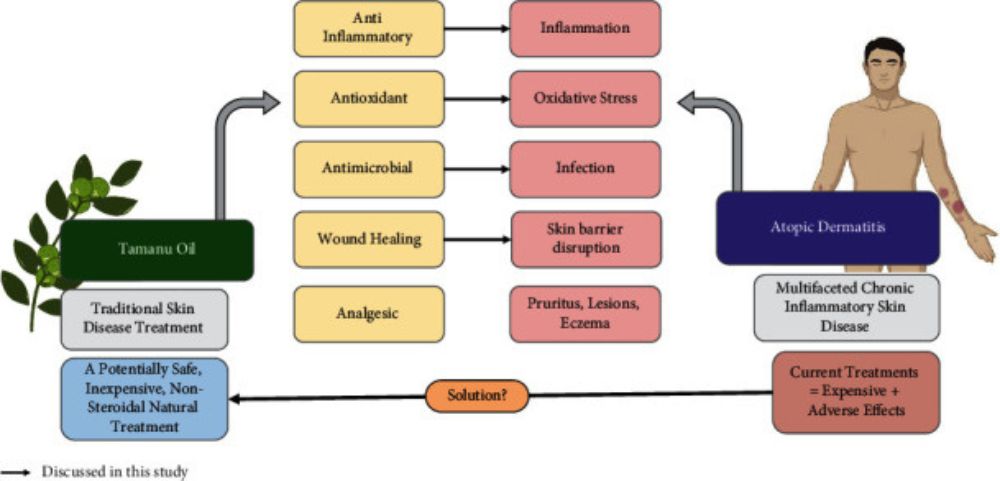
*Tổng quan về tác động của dầu mù u đối với viêm da cơ địa. Các hoạt động của Dầu Mù U (như chống viêm, chống oxy hóa, kháng khuẩn và chữa lành vết thương) liên quan đến bệnh lý học của AD (như viêm, căng thẳng oxy hóa, nhiễm trùng và sự gián đoạn hàng rào da) làm cho dầu mù u trở thành một phương pháp điều trị thay thế mới tiềm năng cho AD.
2. Viêm Da Cơ Địa
Viêm da cơ địa (AD) là một bệnh da viêm nhiễm mãn tính có thể ảnh hưởng đến mọi nhóm tuổi và dân tộc. Tỷ lệ mắc bệnh này thay đổi rất lớn giữa các quốc gia và các nhóm tuổi. AD ảnh hưởng đến khoảng 20% trẻ em trên toàn thế giới. Tại Châu Âu, tỷ lệ mắc AD thay đổi từ 1.8% ở Lithuania đến 17.3% ở Hungary trong số các bạn trẻ từ 13 đến 14 tuổi. Ở các nước đang phát triển của Châu Á, Châu Phi, Mỹ Latinh và Trung Đông, tỷ lệ mắc bệnh dao động không kém như ở trẻ em Châu Âu cùng độ tuổi, với tỷ lệ mắc từ 3–6% được quan sát ở khu vực Trung Đông và 12–14% ở Châu Phi. Mặc dù AD chủ yếu ảnh hưởng đến trẻ em, tỷ lệ mắc AD ở người lớn cũng đáng kể. Trong một nghiên cứu quốc tế được tiến hành vào năm 2018, Barbarot và nhóm của mình đã xác định thành công tỷ lệ mắc AD ở người lớn là khoảng từ 2.1% đến 4.9% giữa các quốc gia.
2.1. Chẩn Đoán và Triệu Chứng Lâm Sàng
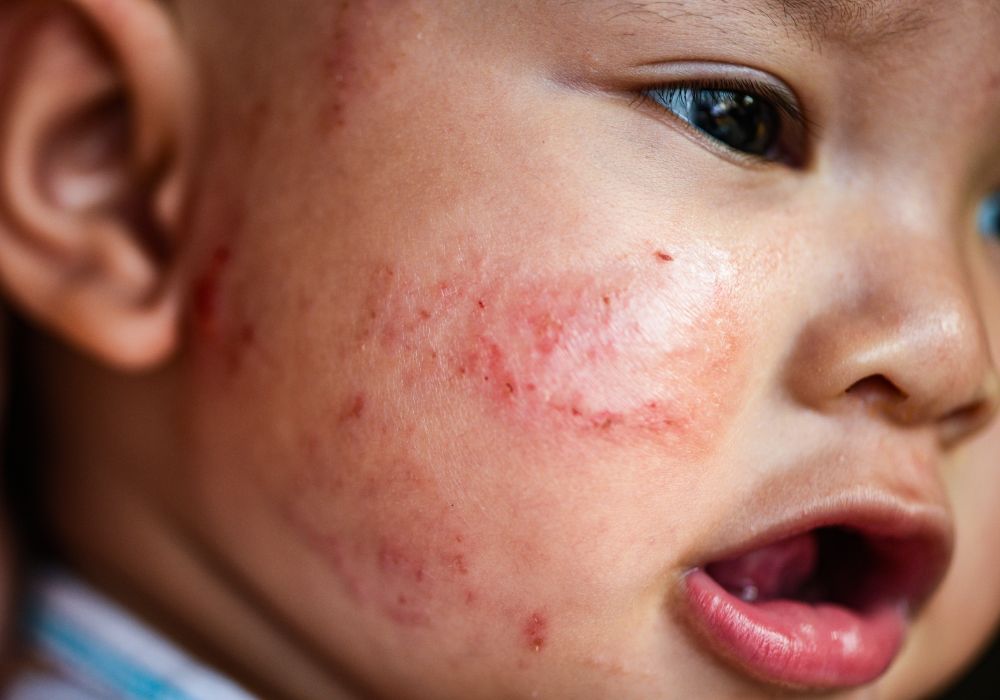
AD được đánh dấu bởi các đợt bùng phát cấp tính của các tổn thương chàm ngứa trên các phần da khô. Chẩn đoán và biểu hiện của AD có thể được phân loại theo độ tuổi. AD ở trẻ sơ sinh, xảy ra trước 2 tuổi, chủ yếu được đánh dấu bởi chàm cấp tính gây ngứa, thường xuất hiện ở đầu và cổ. Cằm, má và trán thường xuất hiện những triệu chứng này, và tổn thương của AD ở trẻ sơ sinh thường chảy dịch và có vảy. Da có thể bị thô ráp ở những khu vực này, phụ thuộc vào việc bong tróc và đỏ. Các chi cũng thường bị ảnh hưởng bởi những triệu chứng này, nhưng các triệu chứng có xu hướng tránh những vùng da liên quan đến khớp như khuỷu tay và đầu gối. Thêm nữa, AD ở trẻ sơ sinh thường không xuất hiện triệu chứng ở vùng tã như háng vì sự ẩm ướt thường được giữ tốt.
Biểu hiện viêm da cơ địa ở trẻ em
AD ở trẻ em phát triển từ độ tuổi 2 đến khi dậy thì. Không giống như trẻ sơ sinh, các tổn thương AD trong thời kỳ này thường khô và thô ráp, đồng thời cổ điển xuất hiện trên bề mặt các khớp như khuỷu tay, đầu gối, cổ tay và mắt cá chân. AD ở trẻ em ít khi ảnh hưởng đến khuôn mặt và khi có thì chủ yếu xuất hiện xung quanh miệng và mắt. Ngứa thường nặng hơn ở trẻ em và cũng có thể cảm thấy khi ngủ. Việc gãi mạnh trong độ tuổi này dẫn đến sự thô ráp của da. Ở người lớn mắc AD, chàm cũng xuất hiện ở các khớp với khả năng tăng cao xuất hiện ở những nơi khác như núm vú hoặc mi mắt. Các mô hình hình thành bởi các khu vực bị ảnh hưởng thường đối xứng và khô, trong khi sự xuất hiện của chảy dịch được sử dụng để phân biệt nhiễm trùng với AD.
2.2. Yếu Tố Nguy Cơ và Bệnh Lý Học của AD
AD là một bệnh cực kỳ đa dạng với nguyên nhân phức tạp, được ảnh hưởng bởi sự kết hợp của các yếu tố gen, môi trường và miễn dịch, dẫn đến sự rối loạn và suy giảm chức năng của hàng rào da và phản ứng miễn dịch. Hiện nay, có hai giả thuyết cố gắng giải thích bệnh lý học của AD. Giả thuyết "từ ngoài vào trong" hỗ trợ quan điểm rằng chức năng hàng rào da bị lỗi dẫn đến sự xâm nhập của kích thích tố và chất kích ứng bên ngoài vào da và các mô bên dưới, tạo ra một phản ứng viêm cấp tính. Ngược lại, giả thuyết "từ trong ra ngoài" tập trung làm sáng tỏ vai trò của hệ thống miễn dịch trong sự tiến triển của AD và đề xuất rằng sự rối loạn của cả phản ứng miễn dịch bẩm sinh và thích nghi gây ra AD. Các nghiên cứu gần đây dường như chỉ ra rằng cả những bất thường của hàng rào da, bị ảnh hưởng bởi một loạt các yếu tố, và rối loạn miễn dịch góp phần vào bệnh lý của bệnh. Trong phần tiếp theo, chúng tôi sẽ trình bày một bài tổng quan ngắn về hiểu biết mới nhất của chúng tôi về vai trò của các yếu tố gen, môi trường và miễn dịch đối với bệnh lý học của AD.
2.2.1. Yếu Tố Gen
Viêm da cơ địa cũng được biết đến là có thể được gây ra hoặc làm trầm trọng thêm bởi các yếu tố di truyền. Trong những năm gần đây, các nhà khoa học đã làm rõ vai trò của gen FLG, mã hóa cho một loại protein cấu trúc đặc biệt trong biểu bì được gọi là filaggrin, trong AD. FLG là một gen giúp phát triển các mô biểu mô bằng cách củng cố lớp sừng và đóng vai trò như hai thành phần của các yếu tố dưỡng ẩm tự nhiên (NMF), có chức năng duy trì hàng rào độ ẩm tự nhiên của da. Các đột biến mất chức năng (LOF) của gen FLG ảnh hưởng đáng kể đến sự toàn vẹn của biểu bì và làm suy giảm chức năng hàng rào da. Sự không hoạt động đúng của hàng rào này cho phép các chất kích ứng bên ngoài dễ dàng tấn công vào các mô bên dưới và được biết đến là tăng mất nước qua biểu bì (TEWL), góp phần vào tình trạng da khô ở bệnh nhân AD (giả thuyết này được gọi là giả thuyết "từ ngoài vào trong"). Một số đột biến của gen FLG đã được xác định trong các trường hợp AD khác nhau; tuy nhiên, các đột biến tạo ra nguy cơ cao nhất của AD là R501x và đột biến 2282del4. Đột biến trong các gen khác ngoài gen FLG cũng được xác định ở một số bệnh nhân AD. Đột biến trên serine protease inhibitor Kazal-type 5 (SPINK5) liên quan đến AD ở dân số Nhật Bản. Hơn nữa, các phức hợp protein bao gồm các kết nối chặt chẽ cũng được biết là bị phá vỡ ở bệnh nhân AD, dẫn đến sự tăng độ thẩm thấu của nước, mầm bệnh và dị ứng vào da. Vai trò của các đột biến này và các khuynh hướng di truyền khác có thể đóng góp vào bệnh lý học của AD vẫn cần được nghiên cứu thêm.
2.2.2. Yếu Tố Môi Trường
Ngoài các yếu tố di truyền, một số yếu tố môi trường được biết đến là có thể kích hoạt và làm trầm trọng thêm AD. Các yếu tố môi trường như khí hậu, căng thẳng, bức xạ tia UV, vi khuẩn, dị ứng và ô nhiễm có thể ảnh hưởng đến sự toàn vẹn của chức năng hàng rào da và khởi phát phản ứng viêm khi một chất kích thích bên ngoài xâm nhập qua hàng rào da bị tổn thương. Tương tự như các nghiên cứu về gen, hiểu biết của chúng ta về tác động của môi trường đối với AD vẫn còn hạn chế.
Trong số các yếu tố môi trường, vi khuẩn đóng một vai trò quan trọng trong bệnh lý của AD. Hoạt động lâm sàng của bệnh da viêm mãn tính này bị ảnh hưởng bởi sự tương tác và phơi nhiễm với vi khuẩn. Thật không may, bệnh nhân có khuyết tật di truyền thường gặp vấn đề trong giám sát miễn dịch trên da cùng với sự giảm sản xuất các peptide kháng khuẩn, có thể làm tăng nguy cơ mắc bệnh. Hơn nữa, sự giảm lượng kháng nguyên và sự thay đổi có thể xảy ra của các thụ thể nhận biết mẫu (PRRs) có thể dẫn đến sự trầm trọng của AD do vi khuẩn, chẳng hạn như S. aureus và thậm chí là Malassezia furfur. Các khuyết tật có mặt trên da cho phép các mầm bệnh xâm nhập vào cơ thể, dẫn đến sự trầm trọng của bệnh. Gần đây, đã có một số bằng chứng cho thấy rối loạn vi sinh vật và sự lấn chiếm của S. aureus có thể xuất hiện trước AD ở trẻ em trong giai đoạn đầu; tuy nhiên, cần nhiều nghiên cứu hơn trong lĩnh vực này.
Vi khuẩn da đóng một vai trò lớn trong bệnh lý của AD, và các loài staphylococcal là những nhân tố chính trong yếu tố này. AD thường được đánh dấu bởi sự mất cân bằng vi sinh vật hoặc sự suy giảm đáng kể trong đa dạng của vi sinh vật. Ngoài ra, một số nghiên cứu đã phát hiện ra rằng S. aureus dường như là một trong những sinh vật chủ yếu xâm lấn các tổn thương trên da và có liên quan đến mức độ nghiêm trọng của bệnh. Những vi sinh vật này đã được liên kết với việc làm trầm trọng và có thể là sự hình thành của bệnh. Màng sinh học đóng một vai trò quan trọng trong vi sinh vật da đặc biệt trong sự kiên trì và bám dính trong môi trường vi sinh da, do đó nó đóng một vai trò lớn trong chức năng của hàng rào biểu bì và do đó là sự điều chỉnh miễn dịch địa phương. Sự kích hoạt mãn tính của hệ thống miễn dịch đối với các cytokine viêm cuối cùng hỗ trợ sự phát triển quá mức của màng sinh học vi khuẩn, và chúng chiếm ưu thế so với các vi sinh vật cộng sinh khác, thay đổi thành phần của vi sinh vật da khỏe mạnh. Điều này có nghĩa là nhắm mục tiêu vào vi sinh vật da có thể dẫn đến một chiến lược điều trị mới.
2.2.3. Yếu Tố Miễn Dịch
Bệnh lý học của AD bị ảnh hưởng bởi hàng loạt phản ứng miễn dịch xảy ra bên trong cơ thể con người. Như đã thảo luận trong phần trước, một trong những đặc điểm phân tử của AD là sự giảm sản xuất các peptide kháng khuẩn da (AMPs). AMPs là một nhóm các protein kị nước được biểu hiện chủ yếu bởi các tế bào biểu bì để trung hòa độc tố từ các loài vi khuẩn gây bệnh sinh sống trên da. Các ví dụ điển hình của AMPs là các defensin B người (hBDs) và cathelicidins. Sự giảm các AMP này có mối tương quan tích cực với chỉ số TEWL cao, độ pH cao, và sự phát triển của S. aureus (SA). Cả IL-4 và IL-13, các cytokine đặc trưng của phản ứng viêm loại II, đã được chỉ ra là dẫn đến sự giảm điều hòa của nhiều AMPs [32]. Lượng AMP thấp cho phép sự xâm lấn của SA và sự giới thiệu của siêu kháng nguyên (SA) vào da, do đó gây ra phản ứng viêm Th-2. Khi siêu kháng nguyên được giới thiệu vào da, việc hấp thụ kháng nguyên được thực hiện bởi các tế bào dendritic cư trú sau khi có thể được kích hoạt bởi IL-25, IL-33 và thymic stromal lymphopoietin (TSLP) do tế bào biểu bì sản xuất. Sự kích hoạt của tế bào dendritic cũng có thể được gây ra bởi các tế bào lymphoid bẩm sinh loại 2 (ILCs) thông qua quá trình tổng hợp IL-5 và IL-13. Sự trình bày của kháng nguyên cho tế bào T và sự kích hoạt tiếp theo của chúng đánh dấu ngưỡng của miễn dịch bẩm sinh.
Khi các tế bào T được kích hoạt, các tế bào Th-2 và các chemokine liên quan của chúng chịu trách nhiệm gây ra nhiều đặc điểm dị ứng phân tử. Đáng chú ý, IL-4, IL-5, IL-10, IL-13, IL-33 và CCL31 có khả năng thúc đẩy chuyển đổi lớp B-tế bào thành IgE, ức chế filaggrin và giảm điều hòa AMPs thậm chí nhiều hơn. Thật vậy, một đặc điểm phân tử khác của AD là mức độ IgE tăng cao, sau đó gây ra các triệu chứng quan sát được (REF). Phản ứng Th-2 cuối cùng sẽ ngừng hoạt động của nó, và các nghiên cứu gần đây đã chỉ ra rằng ở các giai đoạn sau của AD, phản ứng Th-1 được ưa chuộng ngày càng nhiều. Điều này dẫn đến sự tăng các mức IFN-γ và gây ra các tín hiệu apoptosis trên các tế bào biểu bì, làm suy yếu thêm chức năng hàng rào của da. Mức độ IL-17 và IL-22 tăng lên được quan sát thấy trong các tổn thương AD, với IL-22 kích hoạt sự tăng sinh biểu bì và chấm dứt sự phân biệt của các tế bào biểu bì; tại giai đoạn này, miễn dịch thích nghi chiếm ưu thế.
2.2.4. Các Vấn Đề Khi Điều Trị Viêm Da Cơ Địa Hiện Nay
Bản chất đa diện của AD khiến việc điều trị bệnh trở nên phức tạp. Bệnh nhân AD thường có sự kết hợp giữa viêm da và rối loạn chức năng hàng rào da, điều này có nghĩa là một tác nhân điều trị hiệu quả cần phải hỗ trợ giải quyết phản ứng viêm cũng như sửa chữa hàng rào da [34]. Hiện nay có nhiều phương pháp điều trị AD. Những phương pháp này bao gồm điều trị bôi ngoài da không dùng thuốc cũng như dùng thuốc như corticosteroid và các ức chế calcineurin, liệu pháp ánh sáng, và một số phương pháp điều trị toàn thân, chẳng hạn như corticosteroid đường uống, azathioprine, methotrexate và cyclosporine A. Phương pháp điều trị hàng đầu cho AD nhẹ thường bao gồm sử dụng các loại kem dưỡng ẩm không thuốc để làm dịu da khô nứt nẻ và giảm bớt các biểu hiện của AD. Các ức chế calcineurin như Pimecrolimus cũng có thể được áp dụng vì nó có thể tránh một số tác dụng phụ của corticosteroid, như mỏng da. Trong khi corticosteroid tại chỗ hoạt động bằng cách kích hoạt các thụ thể glucocorticoid hạt nhân của chúng ta, từ đó thay đổi biểu hiện cytokine, các ức chế calcineurin tại chỗ làm gián đoạn sự kích hoạt tế bào T sớm và sự giải phóng cytokine tiếp theo. Mặc dù các ức chế calcineurin được coi là lựa chọn an toàn hơn, phương pháp điều trị này cũng đi kèm với các mối quan tâm riêng bao gồm đỏ da, ngứa, cháy rát tạm thời và cảnh báo về khả năng gây ung thư liên quan đến sử dụng lâu dài. Do đó, kho vũ khí của các phương pháp điều trị tại chỗ đang cần được bổ sung an toàn hơn. Ngoài ra, việc điều trị AD toàn thân cũng bị giới hạn và khó khăn với dupilumab là sinh phẩm duy nhất được phê duyệt sử dụng cho các trường hợp AD từ trung bình đến nặng ở trẻ em từ 6 tuổi trở lên vì sinh phẩm này là loại duy nhất có hiệu quả lâu dài và thậm chí dữ liệu thử nghiệm an toàn.
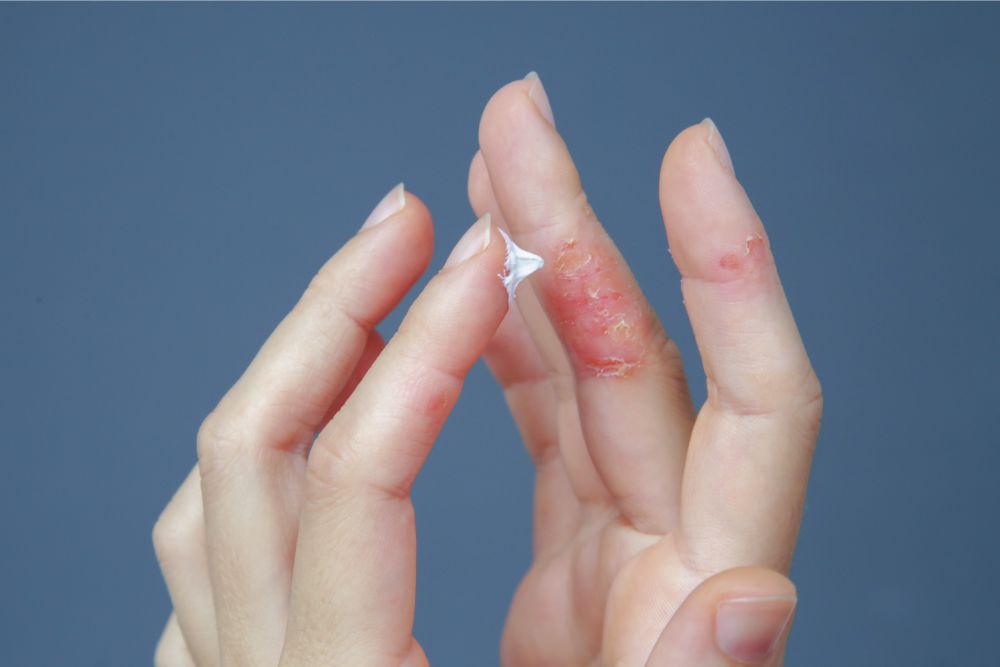
Ngoài việc có các lựa chọn điều trị hạn chế, bệnh nhân AD cũng phải gánh chịu gánh nặng kinh tế đáng kể khi chẩn đoán bệnh này. Thật không may, không phải tất cả bệnh nhân đều có thể quản lý bệnh này bằng các phương pháp điều trị tại chỗ đơn giản. Khi bệnh tiến triển, bệnh nhân thường cần tăng cường mức độ điều trị hoặc sử dụng các phương pháp điều trị khác nhau cùng một lúc. Điều này làm tăng đáng kể chi phí điều trị của họ. Thông thường, bệnh nhân bắt đầu với các loại kem dưỡng ẩm rồi chuyển sang sử dụng corticosteroid hoặc các ức chế calcineurin. Nếu những phương pháp này không hiệu quả, họ sẽ chuyển sang các phương pháp điều trị tiên tiến hơn như liệu pháp ánh sáng đã nêu hoặc thậm chí bắt đầu sử dụng các chất ức chế miễn dịch toàn thân. Những chất ức chế miễn dịch này có thể bao gồm cyclosporin, methotrexate và các loại khác. Một nghiên cứu do Eichenfield và cộng sự thực hiện, được công bố vào năm 2020, đã đánh giá chi phí cũng như các mẫu điều trị của bệnh nhân mắc AD tại Hoa Kỳ. Nghiên cứu này phát hiện rằng chi phí chăm sóc sức khỏe trung bình cho mỗi bệnh nhân mắc các hình thức AD từ trung bình đến nặng có thể lên đến 20.722 đô la mỗi năm. Hầu hết bệnh nhân cần chuyển đổi thuốc hoặc một hình thức điều trị bổ sung do tác dụng không mong muốn của các liệu pháp hiện tại. Nghiên cứu này nhằm làm nổi bật một lý do khác thúc đẩy các nhà khoa học tìm kiếm phương pháp điều trị an toàn và ít tốn kém cho AD, chẳng hạn như Dầu Mù U.
3. Dầu Mù U
3.1. Dầu Mù U là gì?
Dầu Mù U, chiết xuất từ hạt của cây Calophyllum inophyllum L., thu được từ một loại cây thường xanh, phân bố rộng rãi trên khắp các khu vực nhiệt đới ở châu Á, châu Phi và các nước Thái Bình Dương. Tại Polynesia thuộc Pháp, cây này được gọi là cây “mù u”, và nhiều bộ phận của cây đã được sử dụng trong suốt thời gian cho nhiều mục đích y học và thậm chí là làm thành phần hoạt tính trong mỹ phẩm. Phần được sử dụng phổ biến nhất của cây là quả. Nhân hạt có hàm lượng dầu khoảng 75%. Dầu thu được từ hạt của cây mù u theo truyền thống đã được bôi tại chỗ lên da và các tổn thương niêm mạc để ngăn ngừa nhiễm trùng da và thậm chí làm giảm sự xuất hiện của sẹo. Trong nhiều năm qua, Dầu Mù U đã được khuyến nghị cho nhiều vấn đề về da như chàm, mụn trứng cá, vẩy nến, bỏng, nứt da và bệnh da. Nó cũng được sử dụng vì các đặc tính giảm đau trong các bệnh thấp khớp và thần kinh tọa và các đặc tính giảm đau trong việc chữa lành vết thương. Ngoài ra, Dầu Mù U còn được sử dụng ở Fiji để điều trị một số bệnh khác, như đau khớp và viêm kết mạc, thậm chí để ngăn ngừa phát ban ở trẻ sơ sinh.

Những công dụng truyền thống của Dầu Mù U đã thu hút sự chú ý của cộng đồng khoa học. Một số nghiên cứu đã cố gắng xác định các tính chất dược lý khác nhau của dầu và chiết xuất hạt. Một nghiên cứu do Yimdjo và cộng sự thực hiện vào năm 2004 đã tiết lộ một số đặc tính kháng khuẩn của dầu, trong khi các nghiên cứu khác đã tìm thấy các đặc tính sinh học khác như làm lành vết thương, kháng nấm và chống viêm [39]. Bài tổng quan này sẽ xem xét các đặc tính này liên quan đến bệnh lý học của AD và cung cấp các hướng đi tương lai có thể cho các nghiên cứu khám phá khả năng sử dụng Dầu Mù U cho bệnh này.
3.2. Tính chất Dược lý của Chiết xuất Dầu Mù U Liên quan đến AD
3.2.1. Chống Viêm
Rối loạn chức năng hàng rào da trong AD tạo điều kiện cho các tác nhân gây dị ứng và nhiễm trùng xâm nhập vào da, dẫn đến các phản ứng miễn dịch gây viêm. Viêm là một cơ chế phòng thủ của cơ thể nhằm loại bỏ các mầm bệnh và là bước đầu tiên cho quá trình sửa chữa mô tiếp theo. Tuy nhiên, một quá trình viêm kéo dài như trong AD sẽ làm gián đoạn sự cân bằng miễn dịch và ức chế đáng kể quá trình chữa lành vết thương, tạo ra một chu kỳ viêm dữ dội. Một số nghiên cứu đã làm sáng tỏ tính chất chống viêm của Dầu Mù U cả in vitro và in vivo, làm cho loại dầu này trở thành một ứng cử viên hứa hẹn cho việc điều trị AD. Mặc dù các nghiên cứu cũng đã chỉ ra rằng các bộ phận khác của cây mù u cũng có hoạt tính chống viêm, bài tổng quan này sẽ chỉ tập trung vào tính chất chống viêm của Dầu Mù U và các chiết xuất được thu từ hạt mù u.
Dầu Mù U Ép Lạnh
Dầu Mù U ép lạnh giúp làm lành vết thương, giảm viêm, ngừa mụn, dưỡng ẩm, làm mềm da, giảm nếp nhăn.
Xem chi tiếtTrong một nghiên cứu in vitro, chiết xuất Dầu Mù U đã được chứng minh có khả năng ức chế hai enzyme quan trọng trong quá trình viêm, đó là proteinase K (PTA) và lipid oxygenase (15-LOX). LOX là enzyme xúc tác oxy hóa axit arachidonic để tạo ra leukotrienes, những chất trung gian viêm và đã được liên kết với AD. Proteinase K là một enzyme protease serine. Hoạt động bất thường của serine protease ở biểu bì được liên kết với quá trình bệnh lý của AD không chỉ ở các tổn thương mà còn ở các vùng da không tổn thương của bệnh nhân AD. Cassien và cộng sự đã thử nghiệm nhiều phần khác nhau của thành phần nhựa hòa tan trong ethanol của Dầu Mù U (EtTO) và các phân đoạn trung tính (NTR) và axit (ATR) của nó. Các chiết xuất ATR, NTR và EtTO đã được chứng minh có khả năng ức chế 62–72% hoạt động của PTA, gần bằng với sự ức chế của thuốc tiêu chuẩn diclofenac (64%) khi được thử nghiệm ở nồng độ 150 μg/mL. NTR và ATR ức chế 45–60% hoạt động của 15-LOX, trong khi hợp chất tiêu chuẩn quercetin ức chế 83% khi được thử nghiệm ở cùng nồng độ 100 μg/mL.
Các tính chất chống viêm của Dầu Mù U, các chiết xuất và/hoặc các thành phần của chúng cũng đã được chứng minh in vivo. Calophyllolide (CP), một trong những hợp chất hoạt động trong Dầu Mù U, đã được chứng minh làm giảm độ thấm mạch máu ở chuột khi được kích hoạt bởi các chất trung gian hóa học tham gia vào quá trình viêm như histamine (HA), 5-hydroxytryptamine (5-HT) và bradykinin (BK), và nó có biên độ an toàn tương tự với thuốc chống viêm tiêu chuẩn oxyphenbutazone. Trong quá trình viêm, HA, HT và BK có thể làm tăng độ thấm mạch máu cho phép chất lỏng và tế bào miễn dịch xâm nhập vào mô và gây viêm. Tính chống viêm của CP cũng được báo cáo bởi Nguyen và cộng sự, những người đã quan sát thấy sự giảm đáng kể hoạt động của myeloperoxidase (MPO) trên các mẫu mô da vết thương của chuột sau khi điều trị bằng CP. MPO là một enzyme xúc tác hình thành các gốc oxy hoạt tính, một dấu hiệu của viêm. Ngoài ra, nghiên cứu này cũng chứng minh rằng điều trị bằng CP ngăn chặn quá trình viêm kéo dài bằng cách hạ thấp các cytokine viêm toàn thân như IL-1β, IL-6 và TNF-α và tăng cường biểu hiện của cytokine chống viêm IL-10. Hơn nữa, CP góp phần vào hoạt động chữa lành vết thương bằng cách kích hoạt sự chuyển đổi của macrophage từ kiểu M1 sang M2. Điều trị CP cho vùng vết thương đã dẫn đến sự giảm biểu hiện của các gen liên quan đến kiểu macrophage M1 (CD14 và CD127) và tăng biểu hiện của các gen liên quan đến kiểu M2 (CD163 và CD206) so với phương tiện [52]. Trong khi macrophage M1 có tính viêm và góp phần loại bỏ các mầm bệnh vi khuẩn tại chỗ vết thương, macrophage M2 phagocyt các tế bào bị hư hại tại chỗ chấn thương, điều này cũng có lợi cho quá trình chữa lành vết thương.
Mặc dù có nhiều bằng chứng cho thấy Dầu Mù U chứa các hợp chất chống viêm, cho đến nay vẫn chưa có nghiên cứu nào kiểm tra trực tiếp Dầu Mù U và các thành phần của nó đối với viêm da liên quan đến AD. Sự có sẵn của mô hình tế bào của AD như tế bào HaCaT được kích hoạt bởi sự kết hợp của các cytokine liên quan đến tình trạng AD (TNF-α/IFN-γ hoặc IL-4/IL-13)có thể mở đường cho một nghiên cứu chi tiết hơn về cơ chế tác động của Dầu Mù U để cải thiện các triệu chứng của AD.
3.2.2. Hoạt Tính Kháng Khuẩn
Dầu Mù U có khả năng góp phần tăng cường bảo vệ chức năng hàng rào da chống lại sự tấn công của vi khuẩn thông qua ít nhất hai cơ chế kháng khuẩn: ức chế trực tiếp sự phát triển của vi khuẩn và kích thích hoặc điều chỉnh miễn dịch da. Cả dầu và chiết xuất từ hạt mù u đều đã được chứng minh có hoạt tính kháng khuẩn. Dầu Mù U đã được chứng minh thông qua phương pháp oilogramme để ức chế trực tiếp sự phát triển của vi khuẩn Gram dương gây nhiễm trùng da như Staphylococcus aureus, Bacillus cereus, Staphylococcus epidermidis, Staphylococcus haemolyticus, và Corynebacterium minutissimum cũng như những loại gây ra mụn trứng cá như Propionibacterium acnes và Propionibacterium granulosum với nồng độ ức chế tối thiểu (MIC) từ 0.01 đến 0.5%. Khoảng giá trị MIC này được cho là tương đương hoặc thấp hơn so với ofloxacin. Sử dụng một kỹ thuật gọi là sinh hóa đồ, trong đó các thành phần trong Dầu Mù U được tách riêng dựa trên độ phân cực của chúng bằng Chromatography Lớp Mỏng (TLC), các tác giả đã chỉ ra rằng đó là phân đoạn nhựa của dầu, chứ không phải axit béo của nó, là nguyên nhân gây ra hoạt tính kháng khuẩn quan sát được đối với S. aureus. Một nghiên cứu khác đã chỉ ra rằng các hợp chất được cô lập từ chiết xuất thô của hạt mù u sau khi chiết xuất bằng CH2Cl2: MeOH (1:1) thể hiện hoạt tính kháng khuẩn đối với S. aureus (ATCC6538). Những hợp chất này được xác định là CP (MIC: 16 μg), inophyllum C (MIC: 10 μg), và inophyllum E (MIC: 13 μg). Tuy nhiên, hoạt tính kháng khuẩn của chúng vẫn thấp hơn so với chất kiểm soát dương tính oxacillin (MIC: 30 μg) [39]. Ngoài ra, chiết xuất ethanol của Dầu Mù U đã được chứng minh có hoạt tính chống nấm đối với Candida albicans, Candida tropicalis, Aspergillus niger, Aspergillus fumigatus, và Aspergillus tenuissima với nồng độ 4 μg/ml so với chất kiểm soát dương tính fluconazole ở 10 μg/ml. Thú vị là, Dầu Mù U hoặc chiết xuất hạt mù u không được chứng minh là có tác dụng ức chế đáng kể đối với vi khuẩn Gram âm, và cho đến nay, cơ chế mà các hợp chất này ức chế sự phát triển của vi khuẩn vẫn chưa được hiểu rõ.
>>> Xem thêm:
Ngoài việc ức chế trực tiếp sự phát triển của vi khuẩn, Dầu Mù U cũng ảnh hưởng đến sự phát triển của vi khuẩn bằng cách điều chỉnh miễn dịch da. Dầu Mù U đã được chứng minh là kích thích macrophage phái sinh từ U937 giải phóng β-defensin 2, một peptide kháng khuẩn hoạt động chống lại vi khuẩn Gram và có liên quan đến miễn dịch da. Vai trò của Dầu Mù U trong việc kích thích hoặc điều chỉnh phản ứng miễn dịch bẩm sinh của da xứng đáng được nghiên cứu thêm. Hơn nữa, vì sự hình thành màng sinh học của S. aureus đã được chứng minh là cơ chế chính đằng sau quá trình bệnh lý của AD mãn tính, việc xác định liệu Dầu Mù U hoặc chiết xuất có thể đóng vai trò trong việc hình thành màng sinh học của S. aureus hay không vẫn còn là một câu hỏi mở.
3.2.3. Hoạt Động Chữa Lành Vết Thương
Một số nghiên cứu đã chỉ ra rằng khả năng chữa lành vết thương bị suy giảm ở AD, như được Beken et al., vào năm 2020 chỉ ra, nơi mà HaCaT được kích hoạt bởi các tác nhân gây kích thích AD cho thấy sự chữa lành vết thương bị chậm trễ. Nghiên cứu chỉ ra rằng các tác nhân gây kích thích AD làm giảm biểu hiện của các gen E-cadherin và occludin, những gen chịu trách nhiệm sản xuất protein liên kết biểu mô. Ngoài ra, các tác nhân kích thích AD cũng làm tăng biểu hiện của các gen MMP1, MMP2 và MMP9, những gen chịu trách nhiệm phân hủy ma trận ngoại bào (ECM). Biểu hiện của các gen này cần được tăng lên một chút trong quá trình chữa lành vết thương để tạo điều kiện cho sự di chuyển của tế bào. Tuy nhiên, sự biểu hiện quá mức của các gen này có thể can thiệp vào quá trình sửa chữa mô vì nó sẽ dẫn đến sự phân hủy quá mức ECM trong giai đoạn tái tạo mô. Một nghiên cứu khác của Zhao et al. cũng cho thấy sự chữa lành vết thương bị trì hoãn trong mô hình chuột IL-4 Tg cho AD mặc dù có sự phân bào của tế bào biểu bì mạnh mẽ đặc trưng cho bệnh lý học của AD.
CP đã được chứng minh là có tiềm năng hỗ trợ và thúc đẩy chữa lành vết thương dựa trên bằng chứng từ các nghiên cứu trước đây. Một nghiên cứu của Nguyen et al., vào năm 2017, đã chỉ ra rằng CP cải thiện đáng kể diện tích đóng vết thương so với xe cộ (PBS) và đối chứng (Povidone-Iodine). Kết quả giải phẫu bệnh học cũng cho thấy chuột được điều trị bằng CP có sự giảm xơ hóa và tốc độ đóng vết thương nhanh hơn so với xe cộ và đối chứng. Thú vị là, nghiên cứu cho thấy trong giai đoạn phân bào của quá trình chữa lành vết thương ở nhóm được điều trị bằng CP, phần được nhuộm Masson-Trichrome cho thấy sự tái tạo hoàn chỉnh của collagen được lắng đọng trên lớp hạ bì cũng như sẹo collagen nhỏ hơn so với nhóm đối chứng. Trong các giai đoạn tái tạo, đã được quan sát thấy rằng hàm lượng collagen hòa tan cao gấp đôi ở nhóm được điều trị bằng CP vào ngày thứ 10 và giảm vào ngày thứ 14 so với đối chứng.
Leguillier et al. vào năm 2015 và Ansel et al. vào năm 2016 đã thực hiện các nghiên cứu in vitro đánh giá tác động của Dầu Mù U hoặc các chiết xuất của nó đối với tế bào biểu bì cũng như tế bào biểu bì và tế bào sợi, tương ứng. Leguillier tiết lộ rằng điều trị bằng Dầu Mù U cải thiện tốc độ đóng vết thương của tế bào biểu bì được thể hiện qua thí nghiệm scratch lên đến 2.1 lần so với đối chứng, cho thấy tiềm năng của nó được sử dụng như một hợp chất hoạt tính có thể đóng vai trò trong giai đoạn phân bào của quá trình chữa lành vết thương. Trong khi đó, một nghiên cứu của Ansel cho thấy các chiết xuất mù u kích thích sản xuất glycosaminoglycan (GAG) lên đến 350% so với đối chứng trên tế bào HaCaT. Ngoài ra, các điều trị mù u cũng cải thiện sản xuất collagen của tế bào sợi lên đến 40% so với đối chứng sau 24 giờ điều trị bằng các chiết xuất mù u. Sự tăng sản xuất ECM chứng tỏ rằng điều trị mù u có tiềm năng có lợi trong giai đoạn phân bào của quá trình chữa lành vết thương. Điều này cũng được xác nhận thêm bởi Ansel thông qua thí nghiệm scratch thực hiện trên tế bào sợi da người, nơi đóng vết thương nhanh hơn ở các tế bào được điều trị bằng mù u so với các nhóm đối chứng và nhóm được điều trị bằng vitamin C. Các tế bào được điều trị bằng mù u và vitamin C và các tế bào không được điều trị cho thấy đóng vết thương trong 14, 15 và 16 giờ, tương ứng.
Dựa trên những phát hiện này, mặc dù chưa có cơ chế rõ ràng về sự cải thiện đóng vết thương của các tế bào hay động vật được điều trị bằng mù u, sự tăng sản xuất GAG, collagen và tốc độ đóng vết thương nhanh hơn trên tế bào biểu bì cho thấy tiềm năng hứa hẹn của Dầu Mù U và/hoặc các chiết xuất để được sử dụng trong điều trị AD. Vì bệnh lý AD chủ yếu liên quan đến sự rối loạn chức năng hàng rào da, sự cải thiện trong sự phân bào của tế bào biểu bì và sản xuất ECM được kỳ vọng sẽ dẫn đến sự cải thiện hàng rào da, hỗ trợ trong điều trị bệnh lý chính của AD.
3.2.4. Hoạt Tính Chống Oxy Hóa
Căng thẳng oxy hóa có thể đóng vai trò trong quá trình bệnh lý của AD. Căng thẳng oxy hóa làm tăng biểu hiện của các gen cytokine viêm, dẫn đến viêm. Các tế bào viêm, khi được kích hoạt, lần lượt giải phóng các gốc tự do. Viêm da mãn tính xảy ra ở bệnh nhân AD liên quan đến sự sản xuất quá mức các gốc oxy hoạt tính (ROS), như superoxide (O2-) và hydrogen peroxide (H2O2). Bình thường, các tế bào có thể trung hòa ROS bằng cách sử dụng chất chống oxy hóa enzymatic và không enzymatic. Tuy nhiên, ở bệnh nhân AD, mức độ của các chất chống oxy hóa enzymatic và không enzymatic này được báo cáo là đã giảm, khiến bệnh nhân AD dễ bị tổn thương hơn do ROS hoặc các chất oxy hóa so với những người không mắc AD. Ngoài ra, một số dấu ấn sinh học của căng thẳng oxy hóa đã được chỉ ra là tăng cao ở bệnh nhân AD so với những người không mắc AD. Nitric oxide (NO) và malondialdehyde (MDA), cả hai là các sản phẩm cuối của quá trình peroxid hóa lipid, đã được quan sát thấy cao hơn đáng kể ở bệnh nhân AD so với đối chứng.
Dầu Mù U đã được tìm thấy có tính chất chống oxy hóa do khả năng giảm sản xuất ROS trong tế bào [62]. Một trong những enzyme chịu trách nhiệm sản xuất ROS là xanthine oxidase (XO). Một báo cáo gần đây cho thấy thành phần nhựa của Dầu Mù U và các phân đoạn của nó ức chế hoạt động của XO. Các tác giả đã chỉ ra rằng tỷ lệ ức chế XO bởi nhựa và các phân đoạn của nó được quy cho sự hiện diện của tổng hàm lượng phenolic (TPC). Ức chế XO tốt nhất được thể hiện bởi phân đoạn ATR với IC50 là 71 ± 6 μg/mL. Ức chế XO bởi ATR kém hiệu quả hơn so với hợp chất polyphenol tiêu chuẩn là quercetin với IC50 là 1.52 ± 0.12 μg/mL, nhưng gần tương đương với axit gallic với IC50 là 41 ± 1.2 μg/mL. Đáng chú ý là Dầu Mù U không tẩy nhựa (DTO) không ức chế hoạt động của XO. Hoạt động ức chế XO của chiết xuất Dầu Mù U và các phân đoạn nhựa của nó có liên quan với khả năng dập tắt gốc superoxide của chúng như được phản ánh trong các giá trị IC50 từ 14 đến 25 μg/mL. Khả năng chelating kim loại (MCC) phản ánh khả năng của hợp chất ức chế tổn thương do sắt gây ra bằng cách hình thành phức hợp với Fe2+. NTR và ATR, do có hàm lượng phenolic và flavonoid cao, thể hiện mức độ MCC tương đương với quercetin. Tính chất chống oxy hóa của các phân đoạn nhựa của Dầu Mù U cũng được thể hiện bởi mức độ MDA giảm trong các tế bào fibroblast 3T3 được điều trị bằng t-butanol. Ở nồng độ 15 μg/mL, nhựa có khả năng giảm MDA-TBA tốt hơn quercetin ở 3 μg/mL. Nhìn chung, khi so sánh với nguyên liệu Dầu Mù U thô, các phân đoạn nhựa đã được chứng minh có hoạt động chống oxy hóa cải thiện đáng kể. Tổng hợp lại, các tính chất chống oxy hóa của Dầu Mù U có thể tiềm năng cải thiện các triệu chứng của AD, và do đó khả năng sử dụng Dầu Mù U như một phương pháp điều trị tiềm năng cho AD xứng đáng được nghiên cứu thêm. Vì lỗi hàng rào da, nhiễm trùng, viêm và căng thẳng oxy hóa là liên quan trong AD, một liệu pháp đa chế độ là cần thiết. mù u đã được chứng minh có các đặc tính như chống viêm, chống oxy hóa, và kháng khuẩn, và cải thiện chức năng hàng rào da, và do đó, nó có thể là một sản phẩm tự nhiên thay thế cho AD.
4. Kết Luận và Triển Vọng Tương Lai
AD là một bệnh phức tạp và đa diện với ít phương pháp điều trị an toàn và rẻ tiền hiện có. Nhiều nghiên cứu đã được thực hiện để điều tra các tác dụng chống viêm, kháng khuẩn, chữa lành vết thương và chống oxy hóa của Dầu Mù U, khiến nó trở thành một ứng viên tiềm năng cho việc điều trị AD. Quy trình chiết xuất rẻ tiền và nguồn gốc tự nhiên của phương pháp điều trị tiềm năng này làm cho nó trở thành một phương thuốc hấp dẫn để nghiên cứu. Ngoài ra, do bản chất phức tạp của bệnh này, một phương pháp điều trị với nhiều hoạt động như Dầu Mù U là điều mong muốn. Tuy nhiên, để thực sự tìm ra một phương pháp điều trị phù hợp, cần phải tiến hành thêm nghiên cứu để xác định sự khác biệt giữa các mức độ nghiêm trọng của AD để có thể phát hiện ra các phương pháp điều trị thích hợp. Mặc dù có nhiều bằng chứng ủng hộ việc sử dụng Dầu Mù U để điều trị AD, để thực sự kiểm tra tiềm năng này, cần phát triển các mô hình AD thích hợp in vitro và in vivo. Các hợp chất hoạt động chịu trách nhiệm cho hiệu quả cần được xác định và cơ chế tác động của chúng cần được làm sáng tỏ. Các nghiên cứu in vitro sử dụng tế bào biểu bì kích hoạt bằng TFN-α và IFN-γ để mô hình hóa tình trạng AD có thể được sử dụng để nghiên cứu khả năng chống viêm và sửa chữa hàng rào da của Dầu Mù U [64]. Trong khi đó, nghiên cứu in vivo đại diện cho mô hình AD như chuột biến đổi gen hoặc chuột được kích hoạt bằng các chất gây dị ứng cũng có thể được sử dụng để đánh giá hoạt động của Dầu Mù U chống lại AD. Ngoài ra, một số hợp chất sinh học như neoflavanoid tamanolide D và P, inophyllum (C, D, E và P), calophyllolide (CP), calanolide Gut 70 và cả calanolides A, B và D đã được xác định trong phân đoạn hòa tan ethanol của Dầu Mù U. Việc điều tra các tính chất và cơ chế tác động của các hợp chất sinh học này liên quan đến AD cũng là điều cần thiết để xác định các hợp chất có thể được phát triển thêm thành một tác nhân điều trị AD cụ thể. Việc lấp đầy những khoảng trống này có thể góp phần vào việc xác định mức độ nghiêm trọng của AD mà phương pháp điều trị này có thể được áp dụng, và điều này cũng có thể kết luận liệu Dầu Mù U có thể là một ứng viên thuốc mới tiềm năng cho điều trị AD hay không.
*Nguồn:
*Phản hồi và góp ý: Chúng tôi cung cấp thông tin dựa trên khả năng tốt nhất nhưng do nhiều hạn chế nên không thể tránh khỏi sai sót. Chúng tôi hoan nghênh ý kiến và góp ý từ độc giả để cải thiện chất lượng thông tin.

 Tinh dầu nguyên chất
Tinh dầu nguyên chất Tinh dầu hỗn hợp
Tinh dầu hỗn hợp Tinh dầu treo xe
Tinh dầu treo xe Dầu nền
Dầu nền Trầm hương
Trầm hương Phụ kiện khác
Phụ kiện khác Tinh dầu giặt là
Tinh dầu giặt là